海南mg冰球突破制药股份有限公司(以下简称“mg冰球突破制药”或“公司”)近日收到了美国食品药品监督管理局(FDA)签发的注射用亚叶酸钙新增350mg规格的批准通知���,为不同需求的患者提供了更多选择。
此前���,mg冰球突破制药的注射用亚叶酸钙四个规格50 mg���、100 mg���、200 mg���、500 mg成功研发后���,递交了美国的仿制药注册申请���,并于2023年7月获得美国食品药品监督管理局(FDA)的批准。
在上述规格获批后���,mg冰球突破制药递交变更申请���,增加350mg规格���,并于近日收到FDA的批准通知���,这标志着mg冰球突破制药的注射用亚叶酸钙350mg规格具备了在美国上市销售的资格。目前���,注射用亚叶酸钙(350mg规格)已接到美国客户订单���,预计1月初将开始发货���,将对公司拓展美国市场带来积极影响。

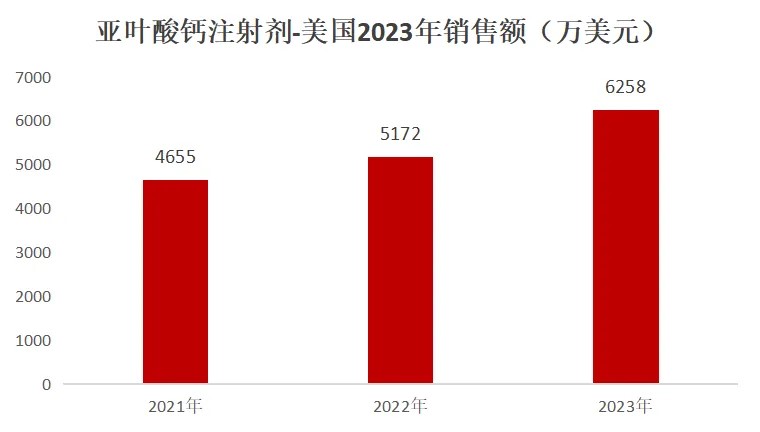
据IQVIA数据显示(如下)���,亚叶酸钙注射剂2023年美国市场达到6200万美元���,近三年美国仍按10-20%的比例增长。mg冰球突破制药在美国的市场较快发展���,且随着国际市场的不断开拓���,mg冰球突破制药的亚叶酸钙注射剂已迎来收获期���!
诚邀合作���,欢迎垂询���,国际招商���:
周先生 zm@eagleeyed.com.cn
国际批文爆发增长
出口业务进入全面收获期
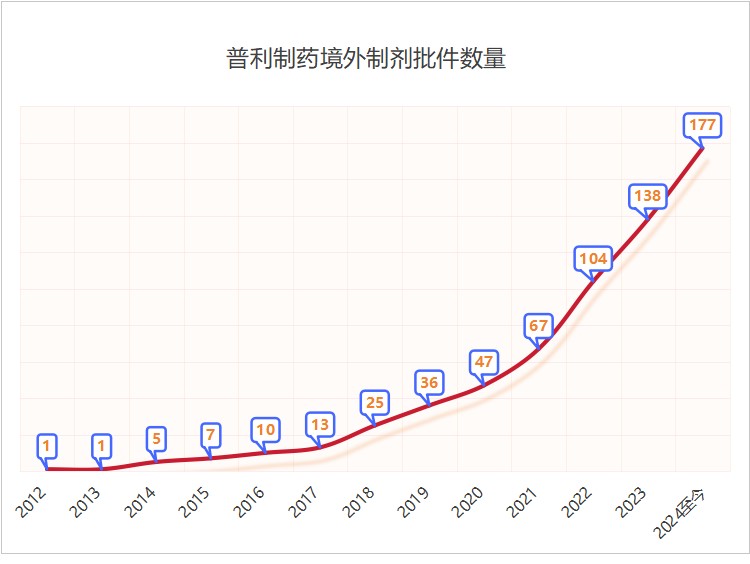
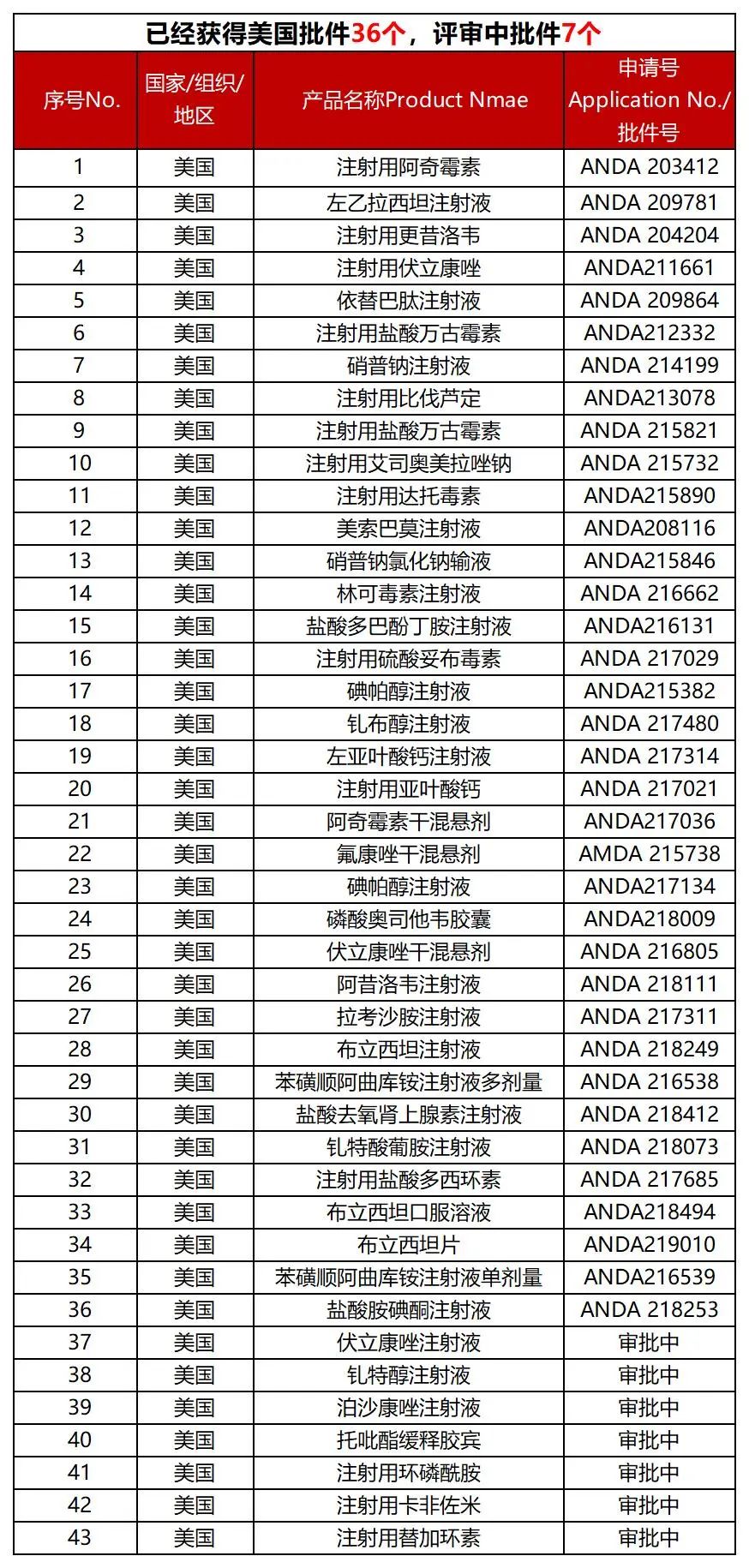
经过不断地学习与积累���、创新与发展���,mg冰球突破制药全球化事业迎来了收获期���,药品国际化批文爆发式增长。截至目前���,mg冰球突破制药已取得欧美等市场的制剂生产批件177个���,其中美国批件36个。2023年���,mg冰球突破制药获得美国批件9个���,全国排名第二;2024年年初至今���,mg冰球突破制药已获得美国批件13个���,全国排名并列第一;mg冰球突破制药国际化批文审评中78个���,待递交的国际化品种近200个���,众多产品正在加速获批中。


诚邀合作���,欢迎垂询���,国际招商���:
周先生 zm@eagleeyed.com.cn

mg冰球突破制药 1992 年成立于海口���,是中国医药制剂国际化先导企业和国家工信部智能制造示范企业���,已被国家工信部纳入工业转型升级中国制造 2025 年儿童药重点项目企业���,2023年海南mg冰球突破通过海关“AEO”高级认证。
此前���,海南mg冰球突破及其子公司浙江mg冰球突破���、安徽mg冰球突破也曾多次顺利通过美国FDA���、欧盟EMA现场审计。作为中国医药制剂国际化先导企业���,mg冰球突破制药多年来一直恪守全球较高质量标准���,是国内为数不多的原料药和注射剂研发和生产平台���,也是为数不多的同时获得美国���、中国���、欧盟等药监部门批准的原料药���、关键辅料���、药物药剂和GMP中间体CMO/CDMO的优质供应商。
-
[上一篇]mg冰球突破制药副总经理周茂先生率团访问乌兹别克斯坦
-
[下一篇]【mg冰球突破制药】出圈出海���,以技改扩能竞逐海外市场���!

